دراسة تكشف كيف تُحفّز طفرة رئيسية مُسبِّبة للسّرطان ظهور المرض
رُبطت الطفرات في المورِّثة TET ميثيل سيتوزين دي أكسيجيناز أو (TET2) بالسّرطان، إلّا أنّ العلماء قد تمكّنوا الآن من فكّ غموض هذا الارتباط، ممّا يفتح بابًا لأهداف جديدة في علاجات السّرطان.
وجٍه فريق بحثيّ من الولايات المتّحدة اهتمامه نحو الحمض النّوويّ الرّيبيّ (RNA) الذي يُسهم في تنفيذ التّعليمات الوراثيّة للحمض النّوويّ الرّيبيّ منقوص الأوكسجين (DNA) وإنتاج البروتينات بدلًا من التّركيز التّقليديّ على (DNA) وحده.
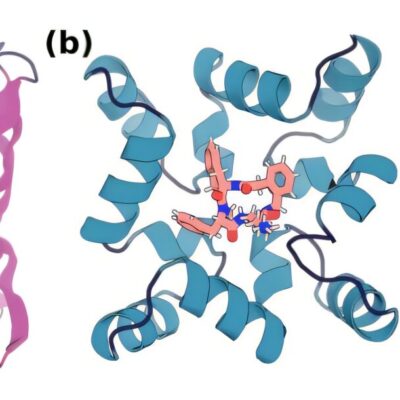
حيث تبيّن أنّ للمورِّثة (TET2) تأثيرًا كبيرًا على عمليّة تُعرف ب «مَثيَلة الحمض النّوويّ الرّيبيّ – RNA Methylation»، والّتي تؤثّر بدورها على كيفيّة تجميع ال (DNA) في وحدات تُسمّى: كروماتين. ويُمكن أن يبدأ السّرطان حين حدوث خلل في هذا الجزء من “العمليّة المُعقّدة” لتغليف وفكّ تغليف البروتينات داخل الخلايا.
يقول تشوان هي، عالم الكيمياء الحيويّة من جامعة شيكاغو: “يمثّل هذا اختراقًا مفاهيميًا؛ إذ أنّ ذلك لا يوفّر أهدافًا للعلاج لعدّة أمراض فحسب؛ بل يُضيف أيضًا إلى الصّورة الشّاملة لتنظيم الكروماتين في علم الأحياء، نأمل أن يكون التّأثير على أرض الواقع كبيرًا.”.
تظهر الطّفرات المرتبطة ب (TET2) في ما يصل إلى 60% من حالات سرطان ابيضاض الدّمّ (اللّوكيميا)، كما ارتبطت بأنواع أخرى من السّرطان.
اعتمد الباحثون على تقنيات متقدّمة في تحرير المورِّثات والتّحليل المختبريّ لفهم العلاقة بين (TET2) ومَثيَلة الحمض النّوويّ الرّيبيّ، فوجدوا أنّ تعديلًا وراثيًّا على RNA يُسمّى: «ميثيل سيتوزين-5 – 5-Methylcytosine» واختصارًا (m5 C) يستقطب بروتينًا يُدعى MBD6، والّذي بدوره يتحكّم في كيفيّة تجميع الكروماتين.
في المراحل المبكّرة من الحياة، تُساعد (TET2) الخلايا على النّموّ من خلال جعل الكروماتين أكثر تيسّرًا، ممّا يدعم تعبير المورِّثات لتتحوّل الخلايا الجذعيّة إلى أنواع مختلفة من الخلايا، أمّا في مرحلة البلوغ، فيُقيّد (TET2) هذا التّيسير عن طريق ضبط نشاط MBD6، ولدى فقدان هذا التّحكّم، قد يحدث اضطراب في آليّات إنتاج الخلايا، ممّا قد يؤدّي إلى السّرطان.
يوضّح تشوان: “إذا كان لديك طفرة في (TET2)، يُمكن أن يُعاد فتح هذا المسار النّمائيّ، ممّا قد يؤدّي إلى السّرطان، خاصّةً في الدّمّ والدّماغ؛ إذ يبدو أنّ هذا المسار ذو أهمّيّة خاصّة في نموّهما”.
أظهرت الفحوص المختبريّة أنّ حجب MBD6 يؤدّي إلى قتل خلايا سرطان الدّمّ، وهذا يُقدّم لنا هدفًا جديدًا لتطوير أدوية مكافحة السّرطان.
ويُضيف تشوان: “نأمل أن نحصل على علاج فعّال يمكنه استهداف الخلايا السّرطانيّة فقط من خلال استهداف هذا المسار المُحدّد”.
كما ترتبط طفرات (TET2) أيضًا لدى كبار السّنّ بزيادة خطر الإصابة بحالات التهابيّة مثل: أمراض القلب، والسّكتة الدّماغيّة، والسّكّريّ؛ وذلك لأنّ الخلايا الدّمويّة الحاملة لطفرات (TET2) تغدو التهابية، فيزداد الضّغط على مختلف أجزاء الجسم.
كما يمكن استخدام العلاجات النّاتجة عن هذا البحث كوسيلة وقائيّة لهذه الحالات أيضًا. يقول جانِر سايجِن، أخصّائيّ الأورام في جامعة شيكاغو: “في الوقت الحالي، لا يمكنني وصف أيّ علاج لهؤلاء المرضى؛ لأنّهم لم يُصابوا بالسّرطان بعد، لكن إذا تمكّنّا من التّخلّص من تلك الخلايا الطافرة، فقد نُحسِّن حياتهم.
- ترجمة: نِهال عامر حلبي
- تدقيق علمي ولغوي: عهدمحروقة
- المصادر: 1