أوّل علاجات جينية لفقر الدم المنجلي
وكالة الغذاء والدواء الأميركية تصرح عن العلاجات الجينية الأولى لفقر الدم المنجلي ومن ضمنها علاج قائم على نظام كريسبر.
في سابقة تعتبر الأولى تاريخيًا وافقت إدارة الغذاء والدواء الأميركية على أول علاج جيني لفقر الدم المنجلي (SCD) الذي يستخدم أداة التعديل الجيني ‘كريسبر’.
قالت الدكتورة نيكول فيردون، مديرة مكتب المنتجات العلاجية في مركز إدارة منتجات البيولوجيا التابع لإدارة الغذاء والدواء، في بيان صدر يوم الجمعة 8 كانون الأول/ديسمبر: “مرض فقر الدم المنجلي اضطراب دموي نادر ومهدد للحياة ويعاني من نقص في العلاجات المستدامة، نحن متحمسون للمضي قدمًا في تطوير هذا المجال من أجل الأفراد الذين تضررت حياتهم بشدة بسبب المرض عبر الموافقة اليوم على علاجين جينيين قائمين على الخلايا ويَعِدُ العلاج الجيني بالإيصال المستهدف والفعال للعلاج، خصوصًا لدى الأفراد المصابين بأمراض نادرة ذات خيارات علاجية محدودة”.
في منصف تشرين الثاني/نوفمبر أصبحت المملكة المتحدة أول بلد يوافق على العلاج الجيني المعتمد على ‘كريسبر’ لدواء يدعى ‘كاسجيفي’.
توقع الخبراء أن يعقب إدارة الغذاء والدواء قرار السلطات البريطانية قريبًا، إذ اعتبر مستشارو إدارة الغذاء والدواء العلاج آمنًا للاستخدام السريري في تشرين الأول/أكتوبر.
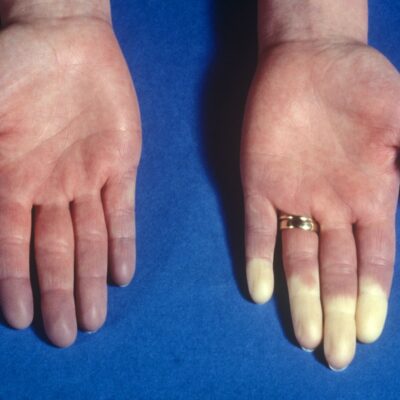
يحدث فقر الدم المنجلي بسبب طفرات جينية تغير هيكل بروتين الهيموغلوبين، الذي يحمل الأوكسجين ضمن كريات الدم الحمراء، لتصبح هذه الكريّات بشكل منجلي عوضًا عن الدائري، مما يسبب الموت السريع للخلايا بالإضافة للتراص، وسد الأوعية الدموية.
الدواء المعتمد على كريسبر ‘كاسجيفي’ يوقف تحول الخلايا إلى الشكل المنجلي عن طريق تثبيط جين يدعى ‘BCL11 A’.
يستطيع نظام كريسبر أن يوجّه ‘مقصّات جزيئية’ للجين المراد إزالته من قِبل الأطباء لدى الحمض النووي للشخص.
تعطيل جين BCL11 A يسمح للجسم بتصنيع نُسخ سليمة من الهيموغلوبين في الجسم، والهيموغلوبين الناضج فقط يتأثر بفقر الدم المنجلي عكس الهيموغلوببين الجنيني، لذا فإن تمكين الجسم من إنتاج هذا الهيموغلوبين الجنيني يعكس الإصابة بفقر الدم المنجلي.
وصرحت وكالة الغذاء والدواء بما يلي: “إن تعزيز إنتاج الهيموغلوبين الجنيني لدى مرضى فقر الدم المنجلي سوف يساعد في بقاء خلايا الدم الحمراء على بقاء شكلها الدائري”.
لتطبيق العلاج، يسحب الأطباء في البداية الخلايا الجذعية الدموية من المريض (خلايا غير متخصصة قادرة على التحول لأي نوع خلوي) ثم يعدلون الخلايا لتعطيل جين BCL11 A ومن ثم إعادة الخلايا لجسم المريض وقبل ذلك يخضع المريض لعلاج كيميائي بهدف التقليل من الخلايا الجذعية غير المعدلة التي لاتزال موجودة ضمن نقي العظم.
العلاج الثاني الذي وافقت عليه إدارة الغذاء والدواء هو ‘ليفجينيا’ وهو غير قائم على نظام كريسبر وإنما قائم على فايروس غير ضار يدعى: ‘العامل الفيروسي البطيء lentiviral vector’ لإيصال المادة الوراثية المطلوبة للخلايا الجذعية الدموية الخاصة بالمريض.
يقوم الفيروس بإدخال جين هيموغلوبين وظيفي ليحل محل الجين المرضي، إذ يصنع الجين الوظيفي نسخة من الهيموغلوبين تشبه إلى حد كبير تلك الموجودة لدى البالغين الأصحاء غير المصابين بمرض فقر الدم المنجلي، ولكنها تحتوي على خصائص إضافية تساعد في تقليل تحول خلايا الدم إلى الشكل المنجلي.
في مرض فقر الدم المنجلي يتغير شكل خلايا الدم عندما يتجمّع الهيموغلوبين الغير طبيعي معًا (يتبلمر) ليشكل سلاسل صلبة داخل الخلايا. الهيموغلوبين المعدل المستخدم في ليفجينيا أكثر مقاومة لتلك العملية من الهيموغلوبين الطبيعي؛ وذلك بسبب هيكله.
يتلقى المرضى -مثلما يحدث في حالة كاسجيفي- معالجة كيميائية قبل تلقي خلاياهم الجديدة التي عولجت بواسطة ليفجينيا.
كاسجيفي معتمد لمرضى فقر الدم المنجلي (SCD) الذين تتراوح أعمارهم بين 12 عامًا وما فوق مع ‘اضطراب التكتل الوعائي المتكرر’ (وهو مصطلح يشير إلى الحالات التي تسد فيها خلايا الدم الحمراء المنجلية تدفق الأكسجين إلى الأعضاء، مما يسبب تلف الأنسجة وآلامًا شديدة).
أما ليفجينيا فهو معتمد للمرضى الذين تتراوح أعمارهم بين 12 عامًا وما فوق ولديهم تاريخ من الأحداث التكتلية الوعائية، وهو الفئة الأوسع التي تندرج تحتها الاضطرابات.
قال الدكتور بيتر ماركس، مدير مركز إدارة الأدوية البيولوجية والبحوث في إدارة الغذاء والدواء: “تتبع الإجراءات اليوم تقييمات دقيقة للبيانات العلمية والسريرية اللازمة لدعم الموافقة، مما يعكس التزام إدارة الغذاء والدواء بتسهيل تطوير علاجات آمنة وفعالة للحالات ذات التأثيرات الشديدة على الصحة البشرية”.
- ترجمة: وداد عنتر
- تدقيق علمي ولغوي: روان نيوف
- المصادر: 1